A enzima asparaginase, que é a base de medicamentos que tratam a leucemia linfoide aguda (LLA), foi melhorada e causa menos irritação ao sistema imune dos pacientes
11/03/2021
Por Antonio Carlos Quinto
Um grupo de cientistas da Faculdade de Ciências Farmacêuticas (FCF) da USP conseguiu produzir em laboratório uma asparaginase menos agressiva ao sistema imune de pacientes portadores de leucemia linfoide aguda (LLA). “A asparaginase é uma enzima usada na composição de medicamentos destinados ao tratamento desse tipo de câncer, que atinge principalmente crianças e adolescentes”, explica a professora Gisele Monteiro, do Departamento de Tecnologia Bioquímico-Farmacêutica da FCF.
Segundo a pesquisadora, apesar de eficientes, os medicamentos para o tratamento da LLA podem causar efeitos que irritam o sistema imune. “Em alguns casos, podem provocar choque anafilático ou necessitar a interrupção do seu uso no tratamento”, ressalta a docente. O trabalho dos pesquisadores resultou no artigo Influence of lysosomal protease sensitivity in the immunogenicity of the antitumor biopharmaceutical asparaginase, publicado na Biochemical Pharmacology, no final de 2020.
A pesquisa mostra que existe a possibilidade de o Brasil produzir a asparaginase menos danosa ao sistema imune contra a LLA. Isso poderia tornar o País independente na produção da enzima, o que possibilitaria também um medicamento mais barato. “Mesmo que o medicamento não venha a ser produzido por aqui, poderemos exportar essa tecnologia”, pondera Gisele, lembrando que a asparaginase é o ingrediente farmacêutico ativo em medicamentos para tratar a LLA usados em todo o mundo.

“No tratamento da LLA, as chances de cura são de 80% e 90%. Mas, se for interrompido, a doença será fatal; somente 20% dessas crianças irão sobreviver. E, no Brasil, temos cerca de 10 mil casos por ano.”

Os medicamentos destinados ao tratamento da LLA são importados e custeados pelo Sistema Único de Saúde (SUS). Segundo Gisele, o medicamento mais administrado atualmente é o Oncaspar. Ele é composto de asparaginase peguilada que resulta de uma técnica bastante usada na indústria farmacêutica. “É uma forma de estabilizar a enzima usando ligação química com o polietilenoglicol (PEG) – técnica chamada peguilação”, descreve Gisele ao Jornal da USP. Mas a pesquisadora destaca que a técnica encarece o processo de produção. O Oncaspar foi recentemente aprovado e autorizado pela Agência Nacional de Vigilância Sanitária (Anvisa) e tem um custo médio de US$ 1 mil a dose.
Nos estudos coordenados por Gisele, além de reduzir a agressividade da asparaginase ao sistema imune, os cientistas também demostram que é possível desenvolver tecnologia 100% nacional para a obtenção de uma enzima menos agressiva. “A asparaginase sem peguilhar também é importada e relativamente cara”, lembra Gisele.

Gisele coordena um grupo de cientistas nos estudos e conta com o apoio da Fundação de Amparo à Pesquisa do Estado de São Paulo (Fapesp), que ela considera fundamental. “No tratamento da LLA, as chances de cura são de 80% a 90%. Mas, se for interrompido, a doença será fatal; somente 20% dessas crianças irão sobreviver. E, no Brasil, temos cerca de 10 mil casos por ano”, estima Iris Munhoz Costa, doutoranda do Departamento de Tecnologia Bioquímico-Farmacêutica da FCF e uma das principais autoras do artigo, ressaltando que a irritação ao sistema imune é uma das principais causas de interrupção do tratamento.
(Veja box abaixo sobre interrupções de tratamento por falta de medicação)
Mil clones
Utilizando técnicas de engenharia genética, os pesquisadores conseguiram então melhorar a asparaginase obtida da bactéria Escherichia coli. “A asparaginase é encontrada em grande parte das bactérias, mas a E. coli produz um tipo da enzima que é capaz de matar o câncer”, descreve a pesquisadora.
O trabalho envolveu análises do DNA da E. coli, que produz uma boa asparaginase mas que, ao mesmo tempo, é capaz de irritar o sistema imune humano. “A partir daí, foram inseridas mutações que causaram diversidade genética e resultaram em mais de mil clones da enzima”, conta Gisele ao Jornal da USP. Dos mil clones, seis foram selecionados por não perderem sua atividade. “Foram os seis clones que mantiveram a principal atividade, que é se aproveitar da deficiência natural das células tumorais na síntese de asparagina”, explica a pesquisadora.
Como já é do saber científico, no sangue humano existem proteases (enzimas capazes de quebrar ligações peptídicas entre os aminoácidos) que quebram a asparaginase expondo as regiões que são reconhecidas pelo sistema imune. “Dos seis clones que mantiveram atividade tumoral, descobrimos dois resistentes e, consequentemente, menos irritantes ao sistema imune”, descreve Iris, lembrando que vários experimentos foram realizados com camundongos.
Dos seis clones que mantiveram atividade tumoral, descobrimos dois resistentes e, consequentemente, menos irritantes ao sistema imune.
A iniciativa coordenada pela professora Gisele envolveu pesquisadores da Universidade de Campinas (Unicamp), Universidade Estadual Paulista (Unesp) e do Instituto de Ciências Biomédicas (ICB) da USP. O início foi em 2014 e a publicação no ano passado.
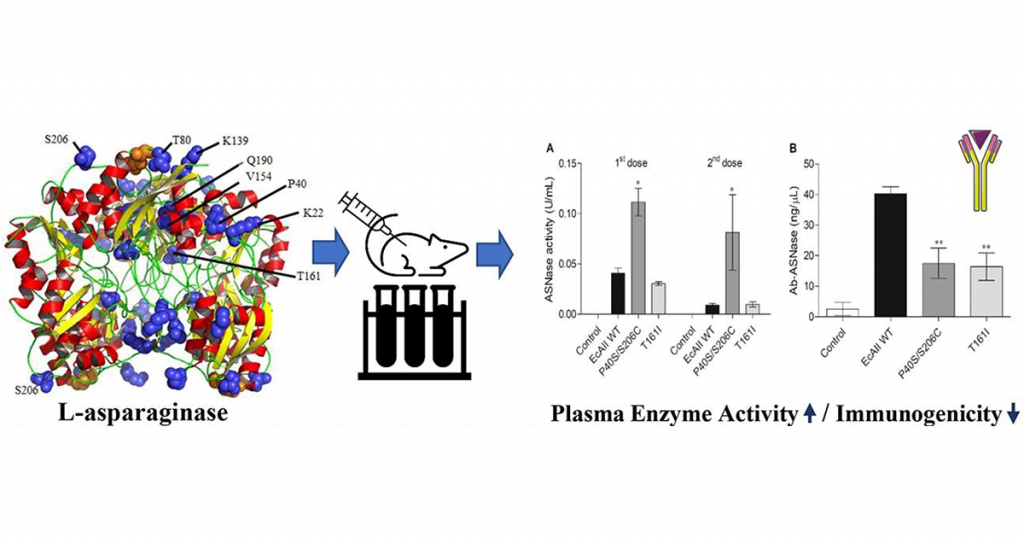
Resumo gráfico dos principais resultados do artigo. As asparaginases melhoradas, quando aplicadas em modelo animal (camundongo), irritam menos o sistema imune resultando em menor título de anticorpos contra asparaginases.
Tecnologia nacional evitaria novos colapsos no tratamento da LLA
Pacientes que sofrem de câncer de medula já tiveram seus tratamentos interrompidos devido à falta de medicamentos. Em 2012, a empresa MDS, responsável pela fabricação da asparaginase (Elspar) utilizada no Brasil, comunicou a interrupção da fabricação desse medicamento. Como lembra Iris, o País ficou sem alternativas para obtenção da asparaginase, pois nenhuma outra marca possuía registro na Agência Nacional de Vigilância Sanitária (Anvisa).
Diante dessa situação, o Ministério da Saúde passou a realizar importações emergenciais para suprir a demanda nacional. Durante esse processo de obtenção, alguns hospitais relataram a falta do medicamento.
Em 2013, logo após a interrupção da fabricação do medicamento, alguns hospitais relataram a falta da asparaginase. Em 2017, alguns médicos optaram por não utilizar a asparaginase chinesa (Leuginase) por terem sido levantados questionamentos sobre a qualidade do medicamento. “No entanto, não há um levantamento estatístico de quantos pacientes deixaram de receber asparaginase, ou vieram a óbito pela falta de tratamento”, observa Iris Munhoz.
Até 2017, não havia registro na Anvisa para comercialização do medicamento, e o País vinha sendo abastecido exclusivamente por importação emergencial. Atualmente, contamos com um único registro da asparaginase (Oncaspar) na Anvisa. “A qualquer alteração no fornecimento desse medicamento por parte do fabricante podemos voltar a depender exclusivamente de importações emergenciais, correndo o risco de escassez do medicamento novamente”, alerta a pesquisadora.
Mais informações: e-mail [email protected], com a pesquisadora Iris Munhoz Costa
Fonte: USP




