Maíra Menezes (IOC/Fiocruz)
Em um estudo recém-publicado na revista científica Nature, uma das mais importantes do mundo, pesquisadores da Fundação Oswaldo Cruz (Fiocruz) e do Instituto Telethon de Genética e Medicina (Tigem), da Itália, desvendam o papel de uma molécula chave para a replicação do vírus Sars-CoV-2, causador da Covid-19. De forma inédita, os cientistas caracterizam a atuação da proteína não estrutural 6 (conhecida pela sigla em inglês, NSP6) na formação dos sítios de replicação viral no interior da célula hospedeira. A pesquisa mostra ainda que diversas variantes do coronavírus apresentam aumento da atividade dessa molécula devido a uma variação genética, o que pode ajudar o vírus a se replicar de forma mais eficiente dentro da célula.
“A maior parte dos estudos sobre variantes do coronavírus se concentra nas mutações que alteram a superfície da partícula viral, que podem ajudar o vírus a escapar da ação dos anticorpos e facilitar a entrada na célula, onde poderá se replicar e, assim, estabelecer a infecção. No nosso trabalho, olhamos para outro aspecto: a capacidade replicativa do vírus. Identificamos que uma alteração na proteína NSP6, que ocorre em diferentes variantes genéticas de preocupação, representa um ganho de função para o patógeno”, afirma a chefe do Laboratório de Imunofarmacologia do Instituto Oswaldo Cruz (IOC/Fiocruz) e uma das autoras do artigo, Patrícia Bozza.
Pelo menos seis variantes de preocupação do coronavírus apresentam um conjunto de deleções no genoma – isto é, ausência de trechos do código genético – que resulta na produção de uma proteína NSP6 de tamanho reduzido. Entre estas, estão duas linhagens que tiveram grande disseminação: a alfa, que emergiu no Reino Unido no final de 2020 e se espalhou rapidamente no país, e a gama, que emergiu no Brasil no mesmo período e se tornou responsável pelo maior número de mortes da pandemia no território brasileiro.
Além disso, na linhagem BA.2 da variante ômicron, o gene que codifica a proteína NSP6 também apresenta variações, sugerindo que há pressão seletiva sobre a função desta proteína. Segundo a Organização Mundial da Saúde (OMS), essa linhagem é predominante em mais de 60 países atualmente.
As mutações no genoma do vírus ocorrem de forma aleatória, mas aquelas que conferem alguma vantagem tendem a ser selecionadas de forma positiva, e podem se propagar mais, gerando um maior número de casos. “As alterações na proteína NSP6 tornam a replicação do vírus mais eficiente dentro da célula. Ao caracterizar a ação dessa proteína e aprofundar o conhecimento sobre o processo de replicação do Sars-CoV-2, nosso estudo fornece novas bases para desenvolvimento de terapias de ação direta contra o coronavírus”, explica o pesquisador do Centro de Desenvolvimento Tecnológico em Saúde (CDTS) e um dos autores do estudo, Thiago Moreno Lopes e Souza.
Organela replicativa
Os vírus não têm a capacidade de se multiplicar sozinhos. Por isso, precisam invadir uma célula e sequestrar a maquinaria celular para replicação do seu material genético e produção das proteínas virais. Ao mesmo tempo, devem se proteger dos mecanismos de defesa da célula, que tentam impedir esse ataque.
Já era conhecido que o coronavírus é capaz de criar organelas especiais dentro da célula para a sua replicação. Essas organelas são vesículas envolvidas por dupla membrana, dentro das quais a produção de cópias do material genético do vírus ocorre de forma protegida.
No entanto, os mecanismos envolvidos na formação dessas organelas eram pouco explorados e nenhum estudo anterior tinha detalhado a função da proteína NSP6 nesse processo. Utilizando diversas técnicas de análise de biologia celular, biotecnologia e virologia, os cientistas descobriram que essa molécula desempenha três funções essenciais para a montagem e funcionamento das organelas replicativas.

Proteína NSP6 forma canais finos que conectam as vesículas de replicação do Sars-CoV-2 (estruturas circulares) ao retículo endoplasmático. Confira no vídeo, os canais observados em células infectadas pela variante gama (imagem: Ricciardi et al; Nature)
Em primeiro lugar, a proteína NSP6 forma canais finos de conexão e atua como um filtro entre as organelas replicativas do Sars-CoV-2 e o retículo endoplasmático – uma importante organela celular, composta por uma rede de tubos e vesículas onde ocorre a produção de diversas moléculas. “Observamos que ela permite a entrada de lipídios [moléculas gordurosas] na vesícula replicativa, mas bloqueia a maior parte das proteínas, que poderiam ser armas da célula contra o coronavírus”, aponta Patrícia.
A atuação da NSP6 também é importante para posicionar e organizar as organelas replicativas, formando estruturas semelhantes a cachos de uvas. Nos ensaios, os pesquisadores observaram que, na ausência dessa proteína, o número de organelas replicativas em cada cacho caía de 15 para três e a forma das organelas se tornava irregular.
Além disso, a proteína promove a associação entre as vesículas replicativas e corpúsculos lipídicos – organelas ricas em lipídios presentes no interior da célula. “A NSP6 atrai os corpúsculos lipídicos para perto das organelas replicativas. Essa é uma forma de o vírus drenar as rotas metabólicas da célula para a sua replicação. Além de constituírem uma fonte importante de energia, os lipídios são necessários para formar as membranas das vesículas replicativas e para a síntese das novas partículas virais, porque o vírus possui um envoltório rico em lipídios”, diz Patrícia.
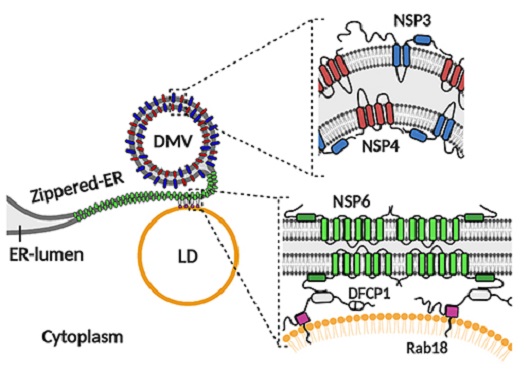
Para formar sua vesícula de replicação, o coronavírus se aproveita da membrana de uma organela celular: o retículo endoplasmático. As proteínas não estruturais 3 e 4 (NSP3 e NSP4) formam a estrutura da vesícula de dupla membrana (DMV), onde ocorre a replicação do genoma viral. A proteína NSP6 forma um tipo de zipper (Zippered-ER), produzindo canais finos na conexão entre o retículo endoplasmático (ER-lumen) e a vesícula replicativa. A molécula também recruta os corpúsculos lipídicos (LD) para o sítio de replicação viral, ligando-se às moléculas DFCP1 e Rab18 (imagem: Ricciardi et al; Nature)
A alteração da proteína NSP6 identificada em diversas variantes do coronavírus torna a molécula mais ativa. Os pesquisadores observaram que, em comparação com o vírus que emergiu inicialmente em Wuhan, na China, as variantes apresentam formação de mais organelas replicativas, com tamanho maior e de forma mais rápida, além de presença elevada da molécula NSP6 nas conexões com o retículo endoplasmático.
“As deleções no genoma também tornam a NSP6 mais hidrofóbica, com melhor capacidade de atrair os corpúsculos lipídicos, aproximando-os dos compartimentos replicativos e manipulando o fluxo energético da célula”, afirma Thiago.
Cooperação em busca de respostas
A caracterização das funções da NSP6 abre portas para o desenvolvimento e aprimoramento de terapias. “Quando entendemos o mecanismo molecular, podemos buscar fármacos que atuem nesses processos. Tendo em vista que a replicação do genoma viral ocorre dentro de membranas lipídicas também podemos considerar que substâncias lipofílicas [que são atraídas por lipídios] podem aumentar a ação de antivirais que atuam inibindo a síntese de RNA”, comenta Thiago.
O estudo foi coordenado pelo Tigem e contou com a colaboração da Universidade de Nápoles Federico II e do Instituto Zooprofilático Experimental do Sul da Itália, além do IOC e do CDTS da Fiocruz. Estudantes de pós-graduação do Programa de Biologia Celular e Molecular do IOC e do Programa de Imunologia da Universidade Federal do Rio de Janeiro (UFRJ) também participaram do trabalho.

Pesquisa uniu abordagens de biologia celular, biotecnologia e virologia em ensaios desenvolvidos no Brasil e na Itália (foto: Gutemberg Brito, IOC/Fiocruz)
A parceria entre os pesquisadores da Fiocruz e os cientistas italianos é um exemplo da importância do rápido estabelecimento de colaborações científicas no enfrentamento da pandemia. Os grupos de pesquisadores nunca tinham trabalhado juntos, mas identificaram interesses comuns e capacidades complementares de pesquisa através de manuscritos divulgados em formato pré-print, que antecipam a divulgação dos resultados das pesquisas, antes do processo de revisão por pares que precede a publicação de artigos em periódicos científicos.
Na Itália, os pesquisadores trabalhavam com mecanismos de tráfego de membranas celulares e a construção de plasmídeos, estruturas genéticas que que são utilizadas para induzir as células a produzir proteínas específicas do vírus. Na Fiocruz, os cientistas já vinham desenvolvendo estudos sobre a importância do metabolismo lipídico na replicação viral e sobre a infecção celular com variantes de preocupação do Sars-CoV-2, um tipo de trabalho que só pode ser realizado em laboratórios com nível de biossegurança 3. A união de esforços permitiu aos pesquisadores desenvolver um estudo completo que contribui para elucidar a questão fundamental sobre como o vírus consegue se apossar das estruturas celulares para a sua replicação.
“A pandemia acelerou o processo de cooperação científica, porque a divulgação acelerada dos resultados facilita a colaboração entre pesquisadores que já têm projetos em andamento”, pontua Thiago. “Nosso trabalho é fruto de um esforço internacional para dar respostas à pandemia. Com isso, chegamos a resultados mais robustos, de forma mais rápida”, ressalta Patrícia.
Fonte: Fio Cruz