Estudo conduzido por pesquisadores americanos mostrou que tratamento experimental pode restaurar parte da visão de pessoas com degeneração hereditária da retina
Durante toda a sua vida, a estudante universitária Olivia Cook tinha apenas um pequeno grau de visão central. Era como se ela estivesse vendo o mundo através de um buraco de canudo e, em lugares pouco iluminados, ela não conseguia distinguir os rostos das pessoas, apenas suas silhuetas.
Mas depois de receber um tratamento experimental de edição genética em um de seus olhos, ela agora consegue ver coisas que nunca viu antes.
Cook nasceu com um distúrbio na retina herdado que causa cegueira, um tipo raro de distúrbio ocular historicamente chamado de amaurose congênita de Leber ou ACL. Há alguns anos, ela decidiu participar de um ensaio clínico que envolvia o uso da ferramenta de edição genética CRISPR para corrigir a forma de cegueira hereditária que ela possui.
“Minha vida mudou principalmente em termos de ter esperança de que haverá mais ciência e descobertas no futuro”, disse Cook, 22 anos, que atualmente está estudando marketing e desenvolvimento de produtos na Universidade Estadual do Missouri em Springfield. Ela recebeu o tratamento experimental de edição genética por meio de uma cirurgia realizada em seu olho esquerdo.
“Agora, pós-cirurgia e pós-recuperação, consigo enxergar em ambientes menos iluminados com meu olho esquerdo”, disse Cook.
Um tratamento que utilizou o CRISPR foi considerado seguro e eficaz na melhoria da visão entre uma pequena amostra de pacientes com cegueira herdada no ensaio clínico de Fase 1/2 em que Cook participou. As degenerações retinianas hereditárias são uma das principais causas de cegueira ao redor do mundo.
Entre um total de 14 voluntários, incluindo Cook, a ferramenta de edição genética foi associada a uma “melhora significativa” na visão para a maioria dos pacientes cerca de três meses depois e não foi diretamente relacionada a nenhum efeito colateral grave, de acordo com os resultados do ensaio, publicados na segunda-feira no New England Journal of Medicine. A terapia continua experimental e os resultados precisam ser replicados em um grupo maior de pessoas.
Meses após o tratamento, Cook estava sentada com amigos em uma varanda que tinha luzes de Natal enroladas no corrimão. Estava anoitecendo, ela lembra, mas conseguia ver o rosto de seus amigos brilhando sob as luzes de Natal piscantes. Ela ficou chocada.
“Com meu olho direito, não conseguia ver as características faciais deles. Só conseguia ver suas silhuetas. Com meu olho esquerdo, eu podia ver tudo em seus rostos – então, diferença significativa, especialmente na iluminação fraca”, diz Cook sobre aquela noite.
“Um dos maiores ‘momentos de epifania’ que tive foi quando estava conversando com minha mãe um dia após a cirurgia — foi cerca de seis a nove meses após a cirurgia quando notei a maior parte da minha melhora”, disse Cook.
“Consegui ver uma vela tremeluzindo atrás de mim, algo que nunca tinha visto antes”, conta. “Nunca tinha percebido nada dali antes com a visão periférica”.
ivia Cook, 22 anos, recebeu a terapia experimental baseada em CRISPR e agora diz que sua visão melhorou / Olivia Cook/Arquivo Pessoal
Antes do tratamento, Cook relatou que, às vezes, conseguia esconder os desafios de visão que enfrentava. Sua visão limitada muitas vezes era uma luta interna.
“Você realmente não saberia que minha visão é terrível até passar um tempo significativo comigo”, disse Cook. “Se nos víssemos na rua, se eu me apresentasse a você, você nunca saberia.”
Mas agora, ela não está mais se escondendo.
Um “prova de conceito” inovadora
Este estudo é a primeira vez que o CRISPR foi usado nos olhos de pessoas vivas.
“Os resultados deste estudo fornecem uma prova de conceito de que a edição de genes CRISPR-Cas9 pode ser usada com segurança e eficácia para tratar distúrbios retinianos hereditários”, disse o primeiro autor do estudo, Eric Pierce, diretor do Instituto de Genômica Ocular no Mass Eye and Ear e na Harvard Medical School.
O ensaio foi financiado pela empresa de biotecnologia Editas Medicine e conduzido nos Estados Unidos por pesquisadores do Mass Eye and Ear do sistema de saúde Mass General Brigham e outras instituições com sede nos EUA, incluindo a Escola de Medicina Perelman da Universidade da Pensilvânia, a Universidade de Michigan, a Universidade de Miami e a Universidade de Saúde e Ciência do Oregon.
“Estamos realmente esperançosos de que as tecnologias de edição de genes CRISPR-Cas9 agora sejam aplicadas a outras formas genéticas de cegueira hereditária e, de fato, a outras doenças genéticas em geral”, disse Pierce. “Estamos esperando que isso ajude a abrir a era do uso terapêutico das tecnologias CRISPR-Cas9.”
O ensaio, que começou em 2019, inscreveu 12 adultos, com idades entre 17 e 63 anos, e duas crianças, com idades entre 9 e 14 anos, com degeneração retiniana hereditária causada por mutações no gene CEP290. Esse gene fornece instruções para a fabricação de uma proteína envolvida em muitos tipos de células, incluindo células receptoras de luz nos olhos. Mutações no CEP290 são a causa mais comum de degeneração retiniana precoce grave, que causa perda de visão em crianças.
Atualmente, não há tratamento aprovado pela FDA (Food and Drug Administration), agência reguladora dos Estados Unidos, para a degeneração retiniana hereditária associada ao CEP290. Esses pacientes não seriam capazes de ler nenhuma linha de letras ou números em um gráfico de visão que a maioria das pessoas recebe no oftalmologista, e o comprometimento visual pode piorar com o tempo.
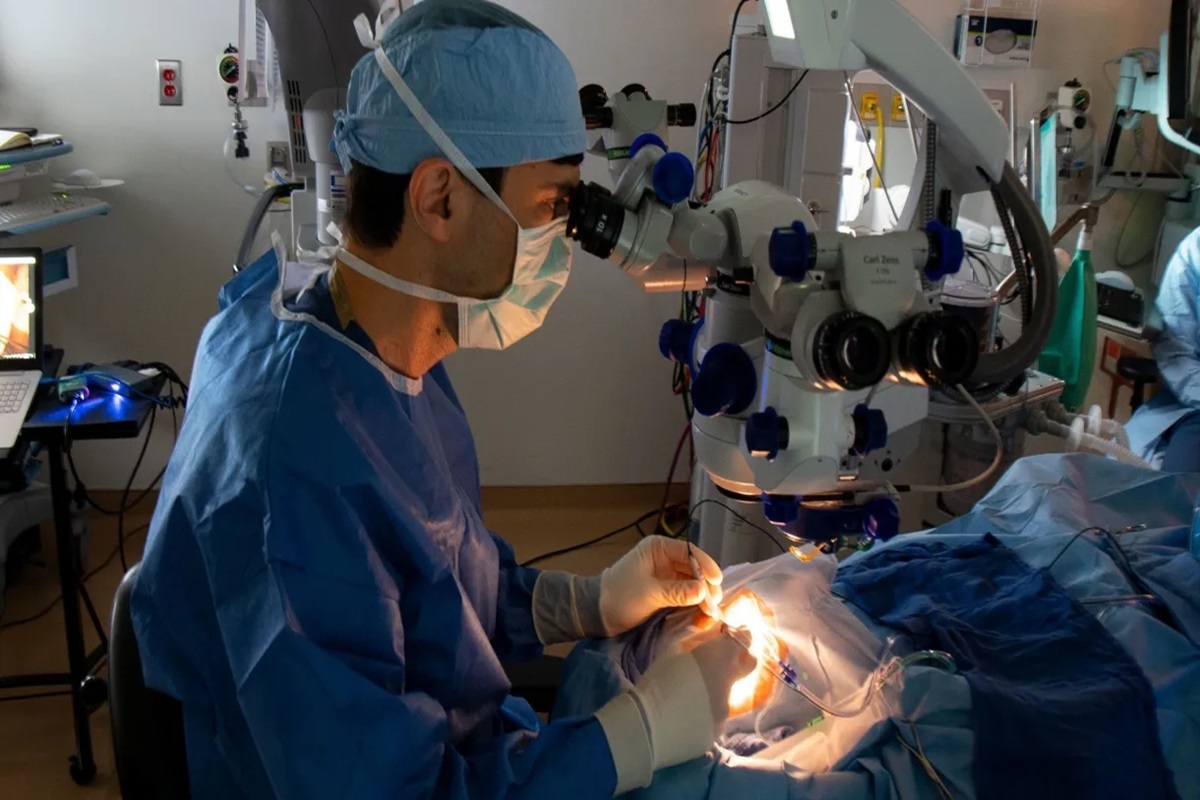
Para o ensaio, os 14 participantes foram submetidos a um procedimento cirúrgico no qual um medicamento chamado EDIT-101, que codifica os componentes de edição de genes CRISPR, foi injetado sob a retina de um dos seus olhos. Como o ensaio foi conduzido principalmente para avaliar segurança e eficácia, apenas um olho de cada paciente foi estudado.
“Os pacientes recebem uma injeção do medicamento de edição de genes, chamado EDIT-101, sob sua retina”, afirma Pierce. “Esse medicamento codifica a maquinaria de edição de genes CRISPR-Cas9, e uma vez que começa a trabalhar dentro das células retinianas desses pacientes, ele remove a mutação no gene CEP290 do genoma de suas células retinianas, permitindo que a função do gene CEP290 seja restaurada.”
Quando os primeiros pacientes do estudo foram tratados em 2020, foi a primeira vez na história médica que um medicamento baseado em CRISPR, resultando em edição de genes, foi inserido diretamente no corpo humano vivo.
Entre os voluntários adultos, dois receberam uma dose baixa do medicamento, cinco receberam uma dose intermediária e cinco receberam uma dose alta. Ambas as crianças no estudo receberam a dose intermediária. O procedimento ambulatorial levou cerca de uma hora e meia.
Os pacientes foram, então, monitorados a cada três meses por um ano e depois a monitoração menos frequente continuou por dois anos. Nestas visitas de acompanhamento, eles passaram por uma série de testes de visão, entre outras avaliações.
Os pesquisadores descobriram que 11 pacientes no estudo tiveram algum tipo de melhora na visão após a terapia com CRISPR, e essas melhorias ocorreram cerca de três meses após o procedimento e foram sustentadas durante as visitas subsequentes.
Além disso, nenhum efeito colateral grave ocorreu em resposta ao tratamento em qualquer uma das doses, de acordo com os pesquisadores, e os eventos adversos que ocorreram foram leves ou moderados. Também não houve sinais de que a edição de genes CRISPR causou danos em cascata aos genomas dos pacientes.
“O objetivo principal deste primeiro estudo em humanos foi testar a segurança do uso da edição de genes CRISPR-Cas9 in vivo. Quando começamos os ensaios, os sujeitos tratados foram os primeiros pacientes a receber tratamentos de edição de genes CRISPR-Cas9 in vivo”, diz Pierce. “Não houve eventos adversos graves relacionados ao tratamento, ou à cirurgia necessária para administrar o tratamento, e nenhuma toxicidade limitante de dose.”
Após a cirurgia, um paciente teve algum sangramento no olho, prejudicando sua visão, mas isso foi resolvido desde então, de acordo com os pesquisadores. “Assim que o sangramento desapareceu, a visão do sujeito voltou ao normal”, disse Pierce.
Outro paciente teve comprometimento da visão associado a pequenos montes observados sob sua retina seis meses após o procedimento. Esses tipos de montes hiper-reflexivos foram observados em outros estudos envolvendo terapias genéticas sub-retinianas, observaram os pesquisadores, e a causa deles não está clara.
“Acredita-se que seja inflamação”, disse Pierce sobre os montes. O paciente foi tratado com um curso de medicamentos esteroides, de acordo com o estudo, e sua recuperação está em andamento. “À medida que os montes se resolveram, sua visão também melhorou”, disse Pierce. “Acredito que este medicamento foi tão seguro quanto possível em termos de design.”
“Não é uma panaceia”
A visão completa não foi restaurada entre os pacientes. A maioria no ensaio não conseguiu ler nenhuma linha de um gráfico de visão antes do estudo, e apenas quatro deles experimentaram algumas melhorias nessa capacidade. Mas alguns pacientes relataram, após o tratamento, serem capazes de ver seus celulares iluminarem, diferenciar vários alimentos em seus pratos de jantar, identificar o ícone da Apple girando em uma tela de computador ou até mesmo notar pores do sol vibrantes.
“Comecei a ver o que são descritos como explosões de cor”, conta Michael Kalberer, 46 anos, que recebeu o tratamento CRISPR em seu olho direito e notou melhorias em sua visão cerca de dois a seis meses depois. Ele começou o estudo em 2020.
“Foi um momento bastante legal ver as luzes estroboscópicas na pista de dança do casamento de meu primo mudarem de cor”, diz Kalberer, que acrescentou que, se não tivesse recebido o tratamento, tudo o que teria visto na pista de dança seriam sombras e luzes piscando, e ele não teria sido capaz de identificar as cores.

Kalberer descreveu o tratamento com CRISPR como “inovador”, mas alertou que não é uma cura.
“Não é uma panaceia”, afirma Kalberer, que ainda não consegue ver texto ou fotos padrão em uma tela. “Minha doença ainda está aqui. Não desapareceu. Eu não estou curado… Mas definitivamente retardou a progressão dela.”
Pierce disse que espera que esta abordagem de usar o CRISPR como terapia para cegueira hereditária possa ser estudada novamente em um grupo maior e mais diversificado de pacientes. Todos os participantes do ensaio de Fase 1/2 eram não-hispânicos e brancos.
Em 2022, a Editas Medicine anunciou que pausou mais estudos sobre a edição de genes CRISPR como uma abordagem terapêutica para a cegueira hereditária associada ao CEP290 e, em vez de conduzir mais ensaios, continuou acompanhando os pacientes que foram tratados até o momento.
Os resultados mais recentes do ensaio de Fase 1/2 apoiam o avanço com um ensaio de Fase 3 e, em última análise, o registro da terapia para possível aprovação da FDA, disse Pierce.
“Estamos trabalhando com a Editas para identificar um parceiro comercial adicional para os estudos de Fase 3. Na verdade, estamos esperando que esta publicação estimule o interesse nas comunidades de biotecnologia e farmacêutica sobre isso”, diz Pierce.
Mais pesquisas ao longo do tempo poderiam lançar luz sobre os efeitos a longo prazo das ferramentas de edição de genes CRISPR-Cas9, que, agora que foram injetadas nos pacientes, estarão presentes nos pacientes pelo resto de suas vidas, considera Pierce.
“Acho que o verdadeiro risco com a edição de genes CRISPR-Cas9 que todos estamos preocupados é: a maquinaria de edição de genes que introduzimos nas células retinianas desses pacientes poderia fazer algo mais, em outro lugar no genoma, além das atividades terapêuticas para as quais foi projetada?”, diz Pierce.
“Um corte no genoma poderia ser feito daqui a 10 anos, que poderia ter um efeito adverso ao longo do tempo? Acho que a resposta para isso é sim, poderia. Mas estamos esperançosos de que o risco seja muito baixo”, afirma Pierce. “É para isso que precisamos de mais acompanhamento.”
“A qualidade de vida importa”
Os resultados do ensaio de Fase 1/2 — e como os pacientes experimentaram algumas melhorias na visão — são um lembrete valioso de como a qualidade de vida pode ser importante para os pacientes, afirma Art Caplan, professor de bioética e chefe fundador da Divisão de Ética Médica do Departamento de Saúde da População da Faculdade de Medicina Grossman da NYU.
“Normalmente, quando estamos fazendo terapias genéticas ou outras intervenções inovadoras, as associamos à salvação de vidas. Este experimento é um lembrete enorme de que a qualidade de vida importa. Isso é sobre visão”, diz Caplan. “Ninguém está morrendo. Ninguém está sendo salvo. Mas a restauração da visão é uma conquista importante, e é um lembrete de que a qualidade de vida deve ser considerada no que decidimos cobrir em termos de seguro, reembolso e no que tentamos estudar.”
Ele concordou com os pesquisadores que mais dados de segurança ao longo do tempo seriam úteis.
“Eles realmente não tiveram esses sujeitos por muito tempo com a intervenção para garantir segurança a longo prazo”, afirma Caplan. “Para esse tipo de intervenções genéticas, você tem que acompanhá-los por longos períodos de tempo – anos – para garantir que outros genes não foram afetados.”
Esses novos resultados do ensaio de Fase 1/2 fornecem um “bloco de construção” para os cientistas trabalharem no futuro ao desenvolver terapias genéticas para tratar distúrbios oculares, afirma Vlad Diaconita, cirurgião retiniano e professor assistente de oftalmologia na Faculdade de Médicos e Cirurgiões da Universidade Columbia. Ele não esteve envolvido no ensaio.
“Isso se aplica à população americana em geral? Não agora”, complementa Diaconita sobre o tratamento experimental.
“No entanto, se aplica aos milhares de crianças nascidas nos anos futuros que têm esse subtipo genético específico. Então sim, uma aprovação dessa entrega genética específica poderia beneficiar as pessoas ao longo do tempo”, diz. “É uma prova de conceito que parece estar nos levando na direção certa.”
A colega de Diaconita, Aliaa Abdelhakim, chamou este estudo de prova de conceito de “inovador” no sentido de que mostra que a abordagem de tratamento pode ser segura e resultar em alguma melhoria para os pacientes, mas mais pesquisas são necessárias em uma escala maior para determinar que tipo de pacientes se beneficiarão a longo prazo e por quanto tempo essas melhorias podem durar.
“Ainda temos que esperar um pouco mais para ver se isso se concretiza a longo prazo”, diz Abdelhakim, oftalmologista-geneticista, especialista em retina e professora assistente de oftalmologia na Faculdade de Médicos e Cirurgiões da Universidade Columbia. Ela também não esteve envolvida no ensaio.
“Não sabemos se as melhorias deste tratamento vão se sustentar. A visão deles vai permanecer melhorada ao longo de suas vidas?”, questiona. “O motivo pelo qual isso é importante é porque esta é a primeira vez que o CRISPR foi usado dessa maneira, nos olhos.”
Fonte: CNN Brasil / Mass Eye and Ear/Divulgação